2017年9月4日,总局官网发布了《医疗器械分类目录》(2017年第104号),新版目录将于2018年8月1日施行。当天,总局发布了《关于实施<医疗器械分类目录>有关事项的通告》(2017年第143号),对新版目录与2002版目录、现行子目录,以及既往分类界定结果的衔接问题,实施过渡期产品注册、备案,以及生产经营许可等相关管理工作进行了说明。
新《分类目录》将2002版目录的43个子目录整合精简为22个子目录(如下图所示);将260个产品类别细化扩充为206个一级产品类别和1157个二级产品类别;增加了产品预期用途和产品描述;在原1008个产品名称举例的基础上,扩充到6609个典型产品名称举例。
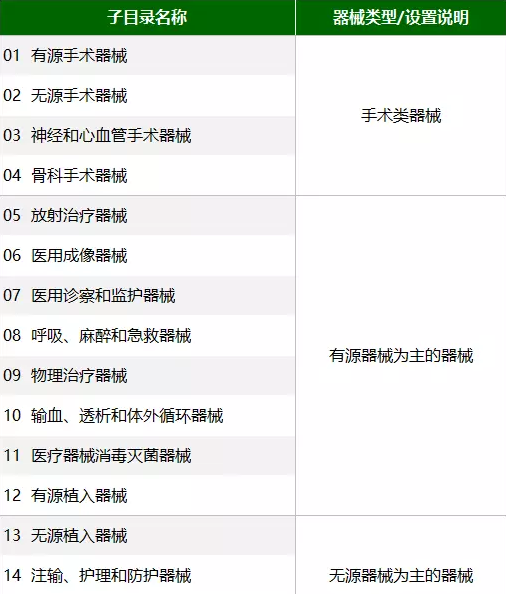
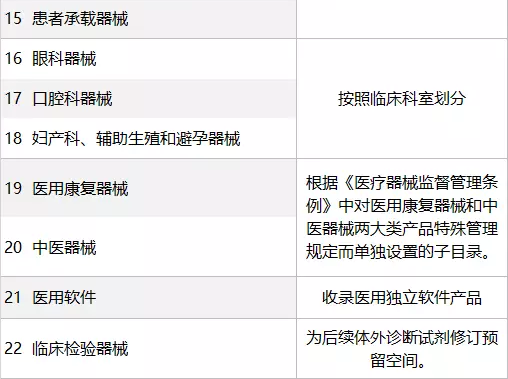
《关于实施<医疗器械分类目录>有关事项的通告》全文如下:
一、新《分类目录》的总体说明
(一)新《分类目录》按技术专业和临床使用特点分为22个子目录,子目录由一级产品类别、二级产品类别、产品描述、预期用途、品名举例和管理类别组成。判定产品的管理类别时,应当根据产品的实际情况,结合新《分类目录》中产品描述、预期用途和品名举例进行综合判定,产品描述和预期用途是用于判定产品的管理类别,不代表相关产品注册内容的完整表述。注册申请人可以使用新《分类目录》的品名举例,或根据《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)拟定产品名称。
(二)新《分类目录》不包括体外诊断试剂,体外诊断试剂产品类别应当按照《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称5号令)、《体外诊断试剂注册管理办法修正案》(总局令第30号,以下简称30号令)、《6840 体外诊断试剂分类子目录(2013版)》及后续发布的分类界定文件中有关体外诊断试剂的分类界定意见进行判定,分类编码继续延用6840。
(三)新《分类目录》不包括组合包类产品,组合包类产品的类别应当依据《医疗器械分类规则》(国家食品药品监督管理总局令第15号)、5号令、30号令等相关规定进行判定。
(四)《关于发布第一类医疗器械产品目录的通告》(国家食品药品监督管理总局通告2014年第8号)、《食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知》(食药监办械管〔2014〕174号)和2014年5月30日以后发布的医疗器械分类界定文件中有关第一类医疗器械产品的分类界定意见继续有效。自2018年8月1日起,上述文件规定的产品管理类别与新《分类目录》不一致的,以新《分类目录》的产品管理类别为准。
(五)自2018年8月1日起,除第(二)项和第(四)项以及既往发布的分类界定文件中不作为医疗器械管理的产品分类界定意见外,原《医疗器械分类目录》(国药监械〔2002〕302号,以下简称原《分类目录》)及既往发布的医疗器械分类界定文件内容及目录废止。
二、医疗器械注册和备案管理有关政策
(六)2018年8月1日前已受理并准予注册的首次注册申请项目,食品药品监督管理部门按照原《分类目录》核发医疗器械注册证。
2018年8月1日前已受理但尚未作出审批决定的首次注册申请项目,食品药品监督管理部门按照原《分类目录》继续审评;准予注册的,如按照新《分类目录》不涉及产品管理类别调整,则按照新《分类目录》核发医疗器械注册证,在注册证备注栏中注明原《分类目录》产品分类编码;如按照新《分类目录》涉及产品管理类别调整,则继续按照原《分类目录》核发医疗器械注册证,并在注册证备注栏中注明新《分类目录》产品管理类别和分类编码(新《分类目录》的分类编码为子目录编号)。
自2018年8月1日起,注册申请人应当按照新《分类目录》提出注册申请。
(七)2018年8月1日前已受理并准予延续注册的申请项目,食品药品监督管理部门按照原《分类目录》核发医疗器械注册证。
2018年8月1日前已受理但尚未作出审批决定的延续注册申请项目,食品药品监督管理部门按照原《分类目录》继续审评;准予延续注册的,如按照新《分类目录》不涉及产品管理类别调整,则按照新《分类目录》核发医疗器械注册证,在注册证备注栏中注明原医疗器械注册证编号;如按照新《分类目录》涉及产品管理类别调整,则继续按照原《分类目录》核发医疗器械注册证,并在注册证备注栏中注明新《分类目录》产品管理类别和分类编码。
自2018年8月1日起,注册人应当按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)和新《分类目录》提出延续注册申请;准予延续注册的,食品药品监督管理部门按照新《分类目录》核发医疗器械注册证,并在注册证备注栏中注明原医疗器械注册证编号。涉及产品管理类别由高类别调整为低类别的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向相应食品药品监督管理部门申请延续注册或者办理备案。食品药品监督管理部门对准予延续注册的,按照新《分类目录》核发医疗器械注册证;对备案资料符合要求的,制作备案凭证;并在注册证备注栏或备案凭证变更情况中注明原医疗器械注册证编号。涉及产品管理类别由低类别调整为高类别的,注册人应当按照改变后的类别向相应食品药品监督管理部门申请注册。在原医疗器械注册证有效期内提出注册申请的,如在开展产品类别转换工作期间注册证到期,注册人可向原审批部门提出原医疗器械注册证延期申请,予以延期的,原则上原医疗器械注册证有效期不得超过2019年8月31日。
(八)对于注册变更申请项目,医疗器械注册变更文件的注册证编号同原医疗器械注册证。如原注册证为按照原《分类目录》核发的,则2018年8月1日后核发的注册变更文件备注栏中同时注明新《分类目录》的产品管理类别和分类编码。
(九)2018年8月1日前已完成备案的第一类医疗器械产品,原备案凭证继续有效。按照新《分类目录》涉及产品类别由低类别调整为高类别的,备案人应当依据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)和新《分类目录》的规定,按照改变后的类别向食品药品监督管理部门申请注册,并于2019年8月31日前完成注册。
自2018年8月1日起,应当按照新《分类目录》和《关于发布第一类医疗器械产品目录的通告》(国家食品药品监督管理总局通告2014年第8号)、《食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知》(食药监办械管〔2014〕174号)以及2014年5月30日后发布的医疗器械分类界定文件中有关第一类医疗器械产品分类界定意见实施备案。
(十)自2017年11月1日至2018年7月31日,国家食品药品监督管理总局医疗器械标准管理中心对医疗器械分类界定的申请,分别依据原《分类目录》和新《分类目录》给出产品管理类别和分类编码;自2018年8月1日起,依据新《分类目录》给出产品管理类别和分类编码。
三、医疗器械生产经营许可有关政策
(十一)自2018年8月1日起,持按照新《分类目录》核发的医疗器械注册证申请医疗器械生产许可的,食品药品监管部门应当依据医疗器械注册证按照新《分类目录》填写《医疗器械生产许可证》的生产范围和医疗器械生产产品登记表,其中生产范围应填写到一级产品类别。
自2018年8月1日起,持按照新《分类目录》核发的医疗器械注册证申请变更《医疗器械生产许可证》生产范围或增加生产产品的,食品药品监管部门应当依据医疗器械注册证将《医疗器械生产许可证》的生产范围和医疗器械生产产品登记表分成原《分类目录》分类编码区和新《分类目录》分类编码区,并明确标识,分别注明产品生产范围和产品信息。其中,按照新《分类目录》填写的生产范围应填写到一级产品类别。新旧版本分类编码产品生产范围不得混编,待全部产品均为新版产品分类编码的注册证后,不再分区。
(十二)自2018年8月1日起,新发放的医疗器械经营许可证和第二类医疗器械经营备案凭证的经营范围应当分成原《分类目录》分类编码区和新《分类目录》分类编码区,并明确标识。经营范围填写到子目录类别。新旧版本分类编码经营范围不得混编,待全部产品均为新版产品分类编码的注册证后,不再分区。
各省级食品药品监督管理部门应当按照国家食品药品监督管理总局的统一部署,组织开展本辖区新《分类目录》培训工作,监督指导相关单位实施新《分类目录》。各级食品药品监督管理部门对新《分类目录》实施过程中遇到的问题要及时研究处理,并及时向上一级食品药品监督管理部门报告。
你家的产品类别归属又是否有变?
以下为赛柏蓝器械梳理出来的降类产品清单:
1、射频消融设备用灌注泵,管理类别由第三类降为第二类。
2、发光二极管(LED)手术照明灯,由第二类降为第一类。
3、“全自动免疫分析仪”,包括“全自动酶联免疫分析仪”、“全自动化学发光免疫分析仪”、“全自动荧光免疫分析仪”,由第三类降为第二类。
4、微生物鉴定药敏分析仪器、微生物药敏培养监测仪器,由第三类降为第二类。
5、洗板机,由第二类降为第一类。
6、2002版分类目录的“6870-2诊断图象处理软件”中的X射线影像处理系统、核医学成像、医用磁共振成像系统等,统一降为第二类。
7、脱敏剂类产品,由第三类降为第二类。
8、银汞合金,由第三类降为第二类。
9、原2002版分类目录中有明确分类的洁牙工作尖和仅用于打磨、抛光的车针,由第二类降为第一类。
10、正畸弹簧,由第二类降为第一类。
11、种植体密封材料,由第三类降为第二类。
12、牙周塞治剂,由第三类降为第二类。
13、洁牙粉,由第三类降为第二类。
14、根管扩大液、根管清洗剂,由第三类降为第二类。
15、临时冠桥树脂,第三类降为第二类。
16、牙托梗,由第二类降为第一类。
17、一次性使用活检针,由第三类降为第二类。
18、足部隔离用品、隔离护罩,由第二类降为第一类。
19、接触胸腔、腹腔、脑室、腰椎、体内创面或体表真皮深层及其以下组织创面的引流导,由第三类降为第二类。
20、造口袋(含造口底盘)、造口护理用品、造口底盘、造口栓、防漏膏、造口护肤粉、造口皮肤保护剂等造口护理产品,由第二类降为第一类。
21、髂骨穿刺针,由第三类降为第二类。
22、用于非慢性创面、接触真皮深层及其以下组织且所含成分不可被人体吸收的医用敷料,由第三类降为第二类。
23、碘液保护帽,由第三类降为第二类。
24、胃肠X射线检查用品中的胃肠道造影显像剂,由第三类降为第二类。
25、胃肠超声显像粉,由第三类降为第二类。
26、放射性核素扫描装置,由第三类降为第二类。
27、内窥镜气囊控制器,由第三类降为第二类。
28、带有LED光源的医用光学放大器具,由第二类降为第一类。
29、接触椎间隙的非无菌提供的骨科重复使用手术器械,由第二类降为第一类。
30、开口用锥(如手锥),由第二类降为第一类。
31、手术操作中可能接触中枢神经系统的非无菌提供的骨科用凿、骨科用锉、骨科用铲、脊柱外科定位/导向/测量器械、脊柱外科开孔扩孔器械、脊柱外科神经根探子、脊柱外科植骨块嵌入器、脊柱外科椎弓根钉尾部切断器、脊柱手术通道器械、脊柱外科椎体复位器、骨科剥离保护器、骨科组织保护器具,由第二类降为第一类。
涉及分类调整和规范管理的产品还包括:
1、髌骨爪,规范为第三类管理。
2、全自动血库系统,规范为第三类管理。
3、眼科用激光光纤,管理类别规范为第三类。
4、光学定位引导系统,统一规范为第三类医疗器械管理。
5、主动呼吸控制系统,调整为第三类医疗器械进行管理。
6、导管消毒连接器,按第三类医疗器械管理。
7、脑压板,由第一类调整为第二类。
8、心血管手术或脑外科手术冲吸器,规范为第二类管理。如脑吸引器由一类升为二类。
9、骨髓抽吸和活检系统电钻,规范为第二类管理。
19、与有源设备(如电动骨钻、电动骨锯、气动骨钻)连接使用的钻头、刀头、锯片、扩髓器、刨刀、磨头等配套工具,规范为第一类管理。
12、口腔科器械:
金属、陶瓷材料制成的固位桩,管理类别规范为第二类。
研磨材料,用于口内按第二类管理,用于口外按第一类管理。
义齿试用材料,如试色糊剂产品,管理类别规范为第一类。
咬合关系记录/检查材料,按第一类管理。
替代体,作为医疗器械管理,管理类别为一类。
13、诊断功能软件,若仅具有辅助诊断功能,不直接给出诊断结论,按照第二类医疗器械管理。若通过其算法(例如,CAD,骨密度除外)对病变部位进行自动识别,并提供明确的诊断提示,则其风险级别相对较高,按照第三类医疗器械管理。
14、含有酒精、碘酊或碘伏,且仅用于临床上对完整皮肤消毒的涂抹及吸液材料,按第二类医疗器械管理。
15、液压传送装置,含液压功能的承载器械按照第二类医疗器械管理,不含液压功能按照第一类医疗器械管理。
16、试镜架,不作为医疗器械管理。
17、注射器用活塞,不按照医疗器械管理。
18、输液瓶贴,不按照医疗器械管理。
19、输注工作站,不按照医疗器械管理。
20、含消毒剂(抗菌剂)阴道填塞产品,不按照医疗器械管理。
21、放射治疗患者床板,不单独按医疗器械管理。
22、医疗信息管理软件,如果仅仅是医院管理工具,管理内容是患者信息等非医疗诊断和/或治疗内容,不按照医疗器械管理。
23、远程医疗会诊系统软件,如果不包含医学图像或者数据,则不按照医疗器械管理。
24、与临床检验有关,但产品自身不具有医疗器械功能的产品,不按照医疗器械管理。如:移液器、移液管,普通反应杯、反应管、反应板,普通采样杯、采样管、样本收集器,在临床实验室用于检测前/后样本传输、加/去盖、条形码识别等功能的样本管理系统等。
CFDA《医疗器械分类目录》颁布详情见:http://www.sfda.gov.cn/WS01/CL1103/177088.html
来源:微信订阅号CMDRA/赛柏蓝器械
